Même à faibles doses, l’exposition au perturbateur endocrinien DEHP altère le développement des dents
Certains perturbateurs endocriniens ont déjà été associés à une altération de la qualité de l’émail des dents. Après avoir montré les effets délétères du bisphénol A sur le développement des dents, une équipe de chercheurs et chercheuses de l’Inserm, d’Université Paris Cité et de Sorbonne Université, au sein du Centre de Recherche des Cordeliers à Paris, en collaboration avec le CNRS[1], s’est désormais penchée sur les effets du DEHP, un perturbateur endocrinien de la famille des phtalates, sur le développement dentaire. L’utilisation du DEHP est fortement réglementée mais il est encore retrouvé dans les contenants alimentaires et certains dispositifs médicaux tels que les équipements des unités de soins intensifs en néonatologie. Les scientifiques ont montré que les dents de souris exposées quotidiennement à de faibles doses de cette substance présentent des défauts dont l’intensité et la prévalence dépend de la dose d’exposition et du sexe de l’animal, les mâles étant plus susceptibles de développer des altérations dentaires que les femelles. Cette découverte confirme l’intérêt d’envisager les défauts de l’émail dentaire comme marqueur précoce d’exposition à des toxiques environnementaux. Cette étude fait l’objet d’une publication dans la revue Environmental Health Perspectives.
-
Sylvie Babajko, directrice de recherche Inserm (Centre de Recherche des Cordeliers)
-
Service de presse de l'Inserm
Les changements environnementaux considérables des dernières décennies ont un impact sur la santé et le bien-être des populations ainsi que sur tous les organismes vivants. Trouver des marqueurs d’exposition aux substances toxiques présentes dans l’environnement est donc un enjeu de taille pour la recherche.
La littérature scientifique suggère que l’émail dentaire pourrait figurer parmi ces marqueurs. En effet, l’analyse de l’émail permet par exemple une évaluation rétrospective des conditions environnementales : soit en identifiant la présence de polluants piégés dans le minéral, soit en distinguant des défauts de l’émail liés à des altérations de l’activité cellulaire survenues au cours de sa formation.
L’exposition à des perturbateurs endocriniens comme le bisphénol A a déjà été associée à une pathologie de l’émail, appelée hypominéralisation des molaires et incisives (MIH), et retrouvée chez environ 15 % des enfants de 6 à 8 ans. D’autres substances font l’objet de surveillance. C’est le cas du DEHP, un perturbateur endocrinien qui, malgré les réglementations et les interdictions, peut encore être présent dans de nombreux dispositifs médicaux et notamment les équipements dans les unités de soins intensifs en néonatalogie[2].
Le DEHP appartient à la famille des phtalates, des composés chimiques couramment utilisés comme assouplissant des matières plastiques. Les phtalates peuvent être retrouvés dans les contenants alimentaires, les biens de consommation, les jouets, les cosmétiques et les dispositifs médicaux. Le 23 novembre 2021[3], la Commission européenne a publié le Règlement n° 2021/2045 modifiant l’annexe XIV en ajoutant des propriétés de perturbation endocrinienne au DEHP, au BBP, au DBP et au DIBP. Suite à ces modifications, certains usages précédemment exemptés doivent faire l’objet d’une autorisation, dont « les dispositifs médicaux et les matériaux en contact avec les aliments comportant du DEHP ».
Compte tenu de la présence répandue du DEHP, de la contamination potentielle par le DEHP des enfants (dont la formation des dents est en cours) et des données antérieures sur les effets de certains perturbateurs endocriniens sur l’émail, des chercheurs et chercheuses de l’Inserm, de l’Université Paris Cité et de Sorbonne Université, au sein du Centre de Recherche des Cordeliers, en collaboration avec le CNRS, ont voulu explorer les effets potentiels du DEHP.
Dans cette étude menée chez la souris, les scientifiques ont observé les effets d’une exposition journalière au DEHP, à faibles doses et à doses plus élevées. Ces doses étaient équivalentes à celles qu’on peut retrouver dans le cadre d’une exposition environnementale :
- 5 microgrammes/kilo/jour : niveau d’exposition quotidienne estimée d’un enfant au DEHP ;
- 50 microgrammes/kilo/jour : niveau d’exposition chez les patients hospitalisés sous perfusion ou dialyse par exemple.
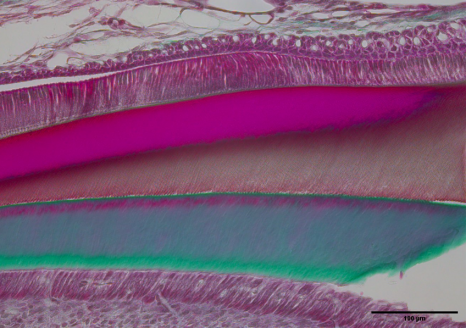
Après 12 semaines d’exposition, des défauts ont été repérés sur les incisives du rongeur, des dents qui ont la particularité d’être en croissance continue[2], et qui représentent le modèle expérimental idéal pour l’étude d’une denture en développement. Moins minéralisées et moins dures, les dents des souris exposées traduisaient une altération de la qualité de l’émail d’autant plus importante que le niveau d’exposition au DEHP était élevé.
Pour compléter ces données, les chercheurs et chercheuses ont ensuite observé aux niveaux cellulaire et moléculaire les effets de cette exposition au DEHP. Ils ont identifié un retard de minéralisation de l’émail associé à une altération de l’expression des gènes clés dans la formation de l’émail. Autre particularité de l’étude, les scientifiques ont comparé l’impact de l’exposition selon le sexe de l’animal et ont observé une susceptibilité plus importante chez les mâles.
Le DEHP a donc perturbé le développement de l’émail chez les souris en agissant directement sur les cellules dentaires avec une prévalence et une gravité plus élevées chez les mâles que chez les femelles.
Enfin, les scientifiques soulignent que les effets observés sur les dents en croissance de rongeurs exposés au DEHP ou au bisphénol A présentent des points communs (altération de la qualité de l’émail, susceptibilité plus importante des mâles) et des différences quant aux cellules ciblées et aux mécanismes moléculaires impliqués.
Ces données expérimentales devront être consolidées mais suggèrent que le DEHP, comme le bisphénol A, pourrait également contribuer aux pathologies hypominéralisantes de l’émail telles que la MIH.
« On sait que la période périnatale et les premières années de la vie après la naissance sont déterminantes pour le développement de l’enfant et la santé de l’adulte qu’il deviendra. L’émail dentaire pourrait être le reflet très précoce des conditions environnementales des individus à ce moment de la vie », explique Sylvie Babajko, directrice de recherche à l’Inserm et dernière auteure de l’étude.
Pour l’équipe de recherche, la prochaine étape est désormais de comprendre les effets de combinaisons de différentes classes de molécules – ou « effets cocktails » – sur la santé dentaire.
[1] Ont participé à ces résultats le Laboratoire de physiopathologie orale moléculaire (Centre de Recherche des Cordeliers/INSERM/Université Paris Cité/Sorbonne Université), le Laboratoire de recherche biomédicale en odontologie (BRIO, UPR2496/Université Paris Cité), l’Institut de chimie physique (ICP, CNRS/Université Paris-Saclay), le Laboratoire de mécanique Paris-Saclay (LMPS, CNRS/CentraleSupélec/ENS Paris-Saclay) et le Laboratoire de neuroscience Paris Seine de l’Institut de biologie Paris Seine (IBPS, CNRS/Inserm/Sorbonne Université).
[2] Malarvannan G, Onghena M, Verstraete S, et al. Phthalate and alternative plasticizers in indwelling medical devices in pediatric intensive care units. J Hazard Mater. 2019; doi:10.1016/j.jhazmat.2018.09.087
[3]https://substitution-phtalates.ineris.fr/fr/information-reglementaire
[4] Les dents de ces animaux croissent de façon continue, tout au long de leur vie, contrairement aux dents de l’Homme.
Références :
Use of dental defects associated with low-dose di(2-ethylhexyl)phthalate as an early marker of exposure to environmental toxicants
Ai Thu Bui1*, Sophia Houari1,2, Sophia Loiodice1,2, Dominique Bazin3, Jérémy Sadoine4, Nicolas Roubier5, Elsa Vennat5, Thu Thuy Tran6, Ariane Berdal1,2, Jean-Marc Ricort1, Sakina Mhaouty-Kodja7, and Sylvie Babajko1
1 Centre de Recherche des Cordeliers, Inserm UMRS 1138, Université Paris Cité, Sorbonne Université, Laboratory of Molecular Oral Pathophysiology, F-75006 Paris, France.
2 Université Paris Cité, Dental Faculty, Department of Oral Biology, F-75006 Paris, France.
3 Université Paris-Saclay, Laboratory of Chemistry and Physics, F-91405 Orsay, France.
4 Université Paris Cité, Dental school, UPR 2496 Laboratory of Orofacial Pathologies, Imaging and Biotherapies, F-92120 Montrouge, France.
5 Laboratory of Mechanics and Technology (LMPS), CNRS, Centrale-Supélec, Université Paris-Saclay.
5 Institut Curie, INSERM U1196, Université Paris-Saclay, F-91405 Orsay, France.
6 Faculty of Odonto-Stomatology, Ho Chi Minh University of Medicine and Pharmacy, Ho Chi Minh Ville, Vietnam.
7 Sorbonne Université, CNRS, INSERM, Neuroscience Paris Seine – Institut de Biologie Paris-Seine, 75005 Paris, France
Environmental Health Perspectives, juin 2022
DOI : https://doi.org/10.1289/EHP10208
Environmental Health Perspectives, juin 2022
DOI : https://doi.org/10.1289/EHP10208
