CATCHFIRE : Un outil innovant pour contrôler la vie intime des cellules et la visualiser par fluorescence
Des chercheurs de l’Institut Curie, du CNRS, de Sorbonne Université et de l’ENS-PSL viennent de développer un outil moléculaire innovant. Appelé CATCHFIRE, il permet non seulement de contrôler le rapprochement de deux protéines mais également de visualiser leur proximité. Ces travaux pluridisciplinaires laissent entrevoir quantités d’applications pour l’étude de processus biologiques fondamentaux mais aussi en biomédecine, pour les maladies génétiques et métaboliques par exemple ou encore dans le domaine de la thérapie cellulaire pour le traitement des cancers. Ces résultats sont publiés le 28 août 2023 dans Nature Methods.
-
Catherine Goupillon-Senghor, service de presse Institut Curie
-
06 13 91 63 63
-
Juliette Mamelonet
-
06 60 82 10 17
Expression des gènes, transport des protéines, activation des voies de signalisation, réponse immunitaire, communication inter- et intra-cellulaire… Tous les processus fondamentaux en biologie sont régis par des mécanismes complexes régulés par la proximité physique de molécules. Comment contrôler et visualiser ces rapprochements pour mieux comprendre et élucider les phénomènes qui se déroulent dans la cellule ? Comment exploiter ces rapprochements dans des applications diverses ?
Les équipes du Pr Arnaud Gautier, chercheur au Laboratoire des Biomolécules (Sorbonne Université, ENS-PSL Université, CNRS) et du Dr Franck Perez, directeur de recherche CNRS à l’Institut Curie (unité Biologie Cellulaire et Cancer /Institut Curie/CNRS) ont conçu un outil moléculaire original et inédit capable de contrôler artificiellement la proximité de deux protéines dans les cellules, mais également de visualiser leurs interactions, afin de disséquer les différents évènements moléculaires impliqués.
Cette nouvelle méthode a été baptisée CATCHFIRE pour Chemically Assisted Tethering of Chimera by Fluorogenic Induced Recognition.
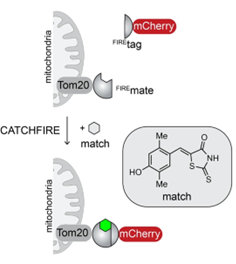
Comment fonctionne CATCHFIRE ? Les deux molécules d’intérêt (par exemple mCherry et Tom20 dans le schéma ci-contre) sont fusionnées à deux petits domaines protéiques (Firemate et Firetag), lesquels sont capables d’interagir ensemble en présence d’une petite molécule synthétique, appelée « match », jouant le rôle de colle moléculaire.
Lorsque les deux domaines interagissent, alors la molécule match voit sa fluorescence augmenter d'un facteur 100. Les chercheurs peuvent alors observer l’interaction nouvellement induite par microscopie de fluorescence. Autre atout du système : il est réversible.
CATCHFIRE en action dans des cellules mammifères co-exprimant la protéine de la membrane externe des mitochondries Tom20 fusionnée à FIREmate et la protéine fluorescente rouge mCherry fusionnée à FIREtag. L’addition de « match » induit l’interaction des deux protéines (visible grâce à l’activation de sa fluorescence verte) conduisant au recrutement de mCherry à la surface des mitochondries.
L’avantage de CATCHFIRE est que cet outil peut se reproduire et s’appliquer à l’envi avec quantité de protéines. Ainsi, cette approche objective et quantitative a permis aux chercheurs de contrôler et suivre différentes interactions impliquées dans le transport et la localisation des protéines, le trafic de protéines sécrétoires, le transport d’organelles tels que les lysosomes, et des mécanismes cellulaires tels que la mitophagie.
De plus, ils ont exploité la nature fluorogénique de CATCHFIRE pour concevoir de nouveaux senseurs, des « biocapteurs » capables de quantifier l’activation de certaines voies de signalisation ou le déclenchement de processus cellulaires tels que l’apoptose (mort cellulaire programmée).
« Notre approche illustre de manière élégante comment la combinaison de concepts et principes provenant de deux disciplines, la chimie et la biologie, permet de concevoir de nouveaux outils moléculaires innovants pour l’étude et le contrôle des fonctions cellulaires, se réjouissent les auteurs, Dr Franck Perez, biologiste, chercheur CNRS à l’Institut Curie et Pr Arnaud Gautier, professeur de chimie à Sorbonne université. Le potentiel applicatif de CATCHFIRE est immense : les possibilités pour l’étude de processus biologiques fondamentaux sont nombreuses, et les développements en biomédecine sont prometteurs, notamment dans le domaine de la thérapie cellulaire qui représente un espoir immense dans les traitements des cancers, des maladies génétiques et métaboliques par exemple ».
Référence :
A fluorogenic chemically induced dimerization technology for controlling, imaging and sensing protein proximity. Sara Bottone, Octave Joliot, Zeyneb Vildan Cakil, Lina El Hajji, Louise-Marie Rakotoarison, Gaelle Boncompain, Franck Perez, Arnaud Gautier.
Nature Methods, 28 August 2023 - https://doi.org/10.1038/s41592-023-01988-8
